| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 |
- 이산화지당 가격
- TIO2가격
- IPA
- 선크림 화학성분
- MEK
- 유독물
- 벤젠
- 가공식품방부제
- 나프탈렌 건강위험성
- 과산화수소유해성과위험성
- Adipic Acid
- 생활속 화학제품
- 카페인
- 할당관세
- MSDS
- 이산화티타늄 가격
- 이산화염소유해성
- 과산화수소 건강 관리
- 이산화염소용도
- 자외선차단제 #피부건강 #징크옥사이드
- xylene
- 부틸화 하이드록시아니솔
- 이산화염소물질정보
- 나프탈렌 안전한 사용법
- 알로에베리
- benzoyl peroxide
- 티나늄이옥사이드
- 과산화수소 활용법
- 옥티노세이트
- ghs
- Today
- Total
케미칼 원재료 정보
산과 염기,PH란 무엇인가? 본문
우리는 일상생활에서 산성,염기성 또는 알칼리성 같은 물질들을 흔히 접하고 생활하고 있는데 잘 모르는 경우가 많이 있다.
그래서 오늘은 산과 염기란 무엇인가? 산과 염기의 특성들에 대해서 한번 알아보도록 하겠다.
산과 염기는 우리 생활과 아주 밀접한 화학 물질이다.
식초처럼 신맛이 나면 산 또는 산성 물질이라고 한다.청소나 세탁에 사용하는 살균 표백제인 락스처럼 손에 묻었을 때 미끈거리는 느낌이 드는 물질을 염기 또는 염기성 물질이라고 한다.
초등학교 때 리트머스 종이 실험을 한 기억을 떠올려 보면 쉽게 이해할 수 있다.
리스트머스(산과염기를 구별하는 지시약)을 사용해 파란색 리트머스 시험지를 빨갛게 바꾸면 “산” 빨간색 리트머스 시험지를 파랗게 바꾸면 “염기”가 된다는 산 과 염기의 성질을 비교하는 대표적인 실험이다.
산과 염기의 구별은 산의 성질을 나타내는 수소이온(H+)을 이용해 특정 기준보다 수소이온이 많으면 산,적으면 염기로 나타내는데 산과 염기의 세기는 모두PH를 사용한다.
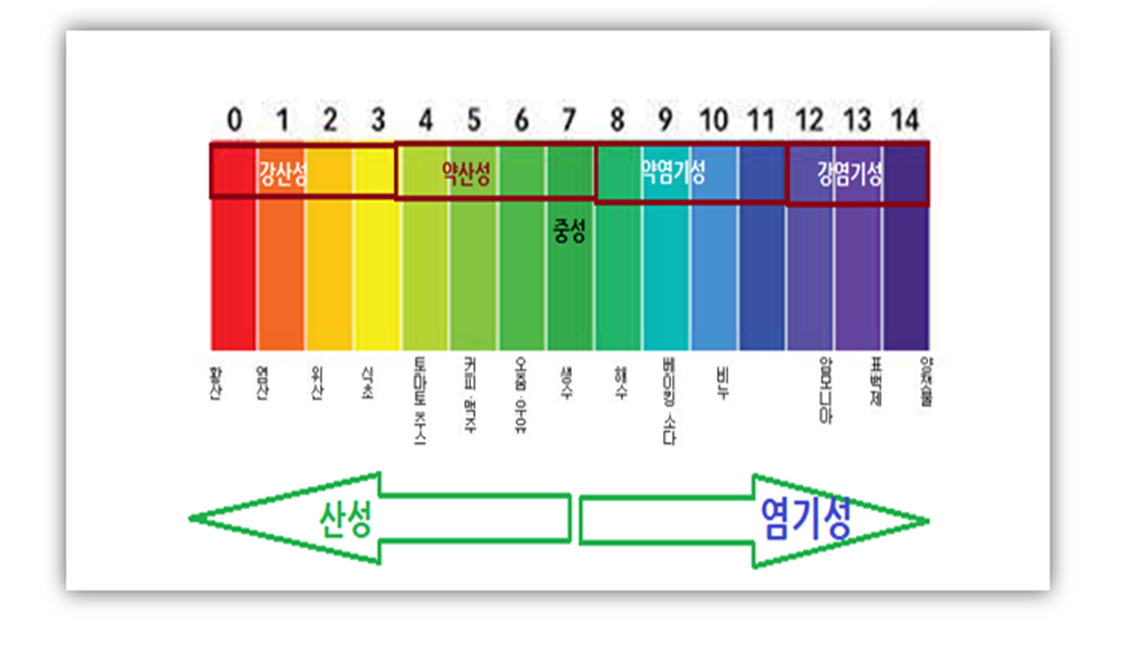
pH(potential of Hydrogen)즉 페하란 수소 이온 지수를 말한다. 물이 이온화하여 물 속의 수소 이온수와 수산화 이온수가 같을 때를 중성용액이라고 하고, 이때의 pH는 7이라고 한다. pH가 7보다 작으면 산성용액, pH가 7보다 크면 염기성 용액이 된다.
0에서 14까지 나타내고 수가 낮을수록 산성이 강하고 클수록 알칼리성이 강 하다. 중성은 pH=7.0, 수돗물은 일반적으로 중성에서 약산성이다
일상생활에서 사용되는 산과 염기의 종류는 매우 많아서 어떤물질이 산 인지 염기 인지 다 알기란 어렵다. 그러나 아주 대표적인 강산과 강염기를 기억하고 있으면 좋을 것 같다.
강산의 경우는 염산(HCL),황산(H2SO4),질산(HNO3) 강염기는 대표적으로 양잿물인 수산화나트륨(NaOH)이다.
건강한 몸의 pH는 7.35~7.45로 약알칼리성이며, 산성 음식을 많이 섭취하면, 신장에서는 오줌을, 폐에서는 이산화탄소를 내보내어 체액의 pH를 적절하게 높인다.
산성과 염기성은 우리가 먹는 음식뿐만 아니라 일상생활에서도 이용되는 여러 가지 제품에도 그 원리가 적용되고 있다.
◆산과 염기의 특성
|
구 분 |
특 성 |
|
산 |
◉ 수용액 상에서 H+를 내놓는 물질 |
|
◉ 신맛이 난다. |
|
|
◉ 금속(철,아연)과 반응해 부식시켜 수소 기체를 발생시킨다. |
|
|
◉ 푸른색 리트머스 종이를 붉게 변화시킨다. |
|
|
◉ 염기와 반응해 중화 반응 (물)이 생성된다. |
|
|
염기 |
◈ 수용액 상에서 OH-를 내놓는 물질 |
|
◈ 쓴맛이 난다 |
|
|
◈ 만지면 미끈거리고 단백질을 녹이는 성질이 있다. |
|
|
◈ 붉은 리트머스 종이를 푸르게 변화시킨다. |
|
|
◈ 산과 반응해 중화반응 (물)이 생성된다 |
산과 염기의반응을 '중화 반응(中和反應, neutralization reaction)'이라고 한다. 중화 반응은 산의 성질을 나타내는 수소 이온(H+)과 염기의 성질을 나타내는 수산화 이온(OH-)이 서로 만나 물이 되는 반응이다. 중화 반응이 완결된, 즉 수소 이온과 수산화 이온이 모두 반응하여 없어진 후에는 더 이상 산 의 성질도 염기의 성질도 찾기 어렵게 된다.
집에서 생선을 굽고 난 뒤 주방세제로 닦아도 생선의 비린내는 것이 쉽게 없어지지 않고 냄새가 나는 경우 이 중화 반응을 이용하여 냄새를 제거 할 수 있다.
세제(염기성)로 닦은 후 식초(산성)를 탄 물로 헹구면 비린내 나는 냄새가 사라진다는 사실이다.
그래서 생활속에서도 간단한 화학공부도 해 둘 필요성이 있다는 것을 새삼 느낀다.
'화학 원재료 자료 > 기타' 카테고리의 다른 글
| 이산화염소의 주요 용도와 유해성 (2) | 2024.09.22 |
|---|---|
| 과산화수소의 주요 효능과 안전한 4가지 활용법 (0) | 2024.09.19 |
| 클로로포름 유해성과 위험성 (0) | 2024.07.02 |
| 리튬, 미래 에너지의 핵심 원소 (0) | 2024.01.27 |
| 페인트(도료)의 정의 및 도료기술의 향후 방향 (0) | 2019.11.15 |